高温热冲击技术快速制备Mn掺杂Fe/Mn@CC阴极提高电芬顿中H2O2的原位生成和活化

第一作者:李彦超(liyanchao1115@163.com)
通讯作者:王灿(wangcan@tju.edu.cn)
通讯作者:赵欣(xinzhao@tju.edu.cn)
通讯单位:天津大学
DOI:https://doi.org/10.1016/j.chemosphere.2022.136074
期刊名称:Chemosphere
图文摘要
通过高温热冲击(HTS)技术成功地制备了Fe/Mn@CC,并将其用作非均相电芬顿(hetero EF)阴极来降解甲基异噻唑啉酮(MIT)。Fe/Mn@CC电极上掺杂着被碳层包裹的纳米Fe和Mn的氧化物,其可以通过提高电化学活性面积和降低电阻的来提高电催化性能。Fe/Mn@CC改性阴极可以有效地原位生成和活化H2O2,对MIT降解显示出高的电催化活性。在电流30 mA、曝气强度0.75 L min-1和初始pH=3的条件下,100 min内MIT降解95.2%。根据CV曲线和稳定性测试,高效的降解能力归因于FeII/MnII的还原再生和H2O2的活化。FeII/III和MnII/III之间的电子转移,以及阴极上FeII/MnII的直接再生,可以显著促进H2O2的利用,最终加速MIT降解。
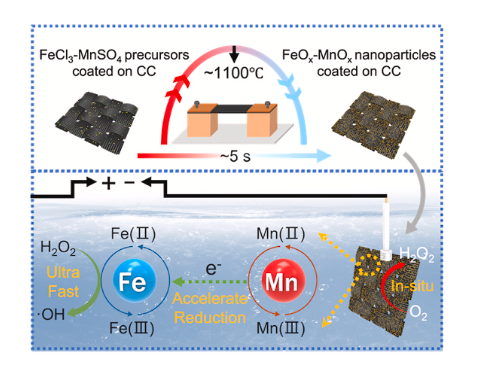
研究背景
电芬顿(EF)作为最有前途的电化学高级氧化工艺(EAOP)之一,近期在降解持久性有机废水污染物方面具有巨大成就。在EF系统中,H2O2通过阴极上的双电子氧还原反应(ORR)原位生成,其在金属离子催化下产生·OH。原位生成H2O2可以消除生产、运输和储存高剂量H2O2带来的相关风险。同时,Fe3+可以在阴极再生成Fe2+,从而显著提高了降解的持久性并减少了铁泥的产生。
通常,H2O2合成和H2O2活化为·OH是主要的EF问题。阴极材料的类型和特性影响反应路径和在ORR过程中传输的电子的数量。碳质材料由于其独特的性能,如高稳定性、低毒性、低成本和对双电子ORR路径的高选择性,已广泛用于H2O2的原位生产,如石墨、石墨纤维(GF)、碳毡(CF)和活性碳纤维(ACF)。
与均相电芬顿(homo-EF)相比,使用固体催化剂修饰电极的非均相电芬顿(hetero-EF)已经引起了广泛的关注。目前的主要方向是在铁作为催化剂的碳阴极上原位生成和活化H2O2。过渡金属具有多种价态,低态过渡金属离子可用作电子给体,催化H2O2生成·OH。此外,多金属掺杂的碳材料可以改善催化活性、多价金属之间的电子/电荷传输和比表面积。与其他非贵过渡金属相比,锰基材料具有可用性、低毒性和多价性。Mn2+更容易再生,因为Mn3+的标准还原电势大于Fe3+,并且倾向于更快地接受电子。此外,Fe和Mn之间的电子协同作用和相互作用可以提高电导率,从而提高了·OH产率并有助于污染物的降解。
目前,hetero-EF催化剂电极存在一些问题,如分布不均匀、易聚集、大颗粒和催化效率低等。通常,多金属的稳定、有序和均匀掺杂是多金属基碳阴极制备的关键。高温热冲击(HTS)技术使用焦耳热来提供大梯度热场,以驱动粉末中颗粒的定向扩散,高温有利于不同金属的完全混合,快速淬火确保了纳米颗粒的小尺寸和均匀分散,在焦耳加热处理过程中,由于金属的催化作用,在金属纳米颗粒表面形成薄碳层。高温热冲击技术可用于合成核壳复合材料,在控制晶体尺寸、界面结构甚至电子结构方面显示出明显的优势。此外,该方法具有无催化剂、绿色、高效的特点,可同时合成催化剂和导电基材复合材料。
图文总结
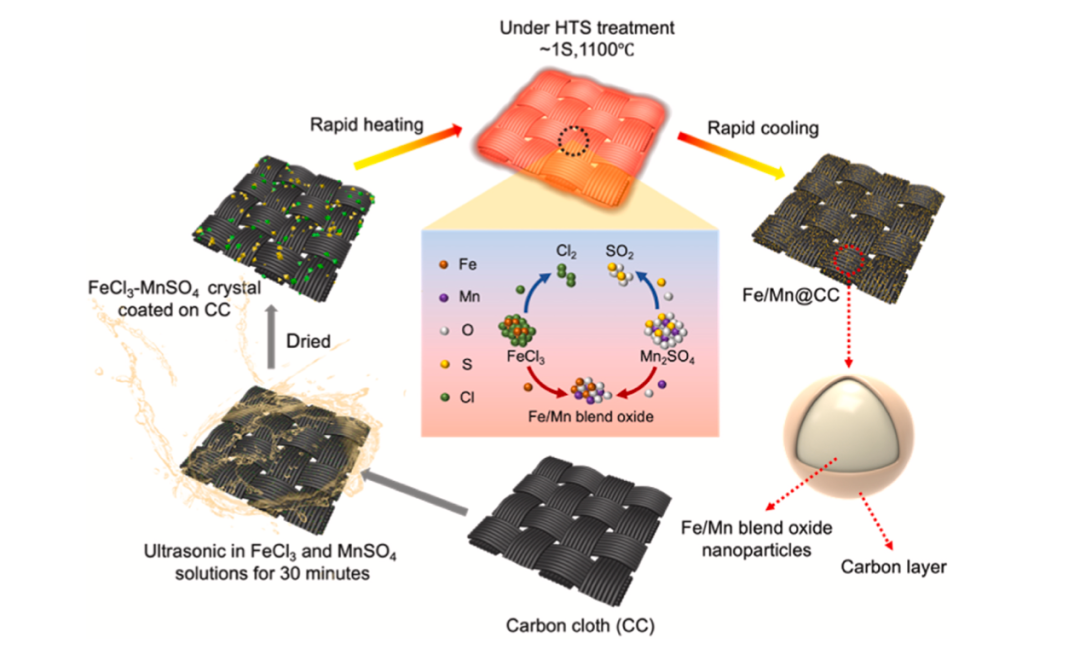
图1 高温热冲击技术制备Fe/Mn@CC阴极示意图
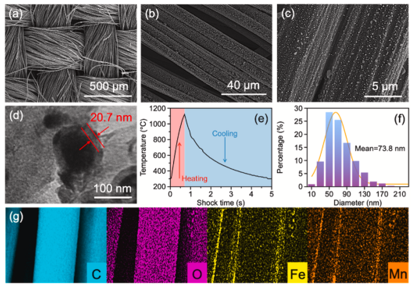
图2 Fe/Mn@CC阴极表征:(a–c)不同放大倍数的SEM图像,(d)TEM图像,(e)高温热冲击过程中温度随时间变化,(f)粒径分布,(g)C、O、Fe和Mn元素图
图2(a–c)显示了通过HTS技术在1100℃(图2(e))真空条件下获得的Fe/Mn@CC在不同放大倍数下的SEM。Fe/Mn颗粒在CC上以小的球形形态存在。从SEM(图2(c))取1000个颗粒点用于粒度统计,Fe/Mn@CC上的球形颗粒均匀分散在CC上,平均直径为≈73.8 nm(图2(f))。图2(d)中的TEM表明,Fe/Mn具有球形形态,包裹在平均厚度为≈20.7 nm核壳结构中。此外,通过EDS(图2(g))元素图显示,O、Fe和Mn在CC上均匀分布高度重叠,表明Fe/Mn在碳结构中共掺杂。
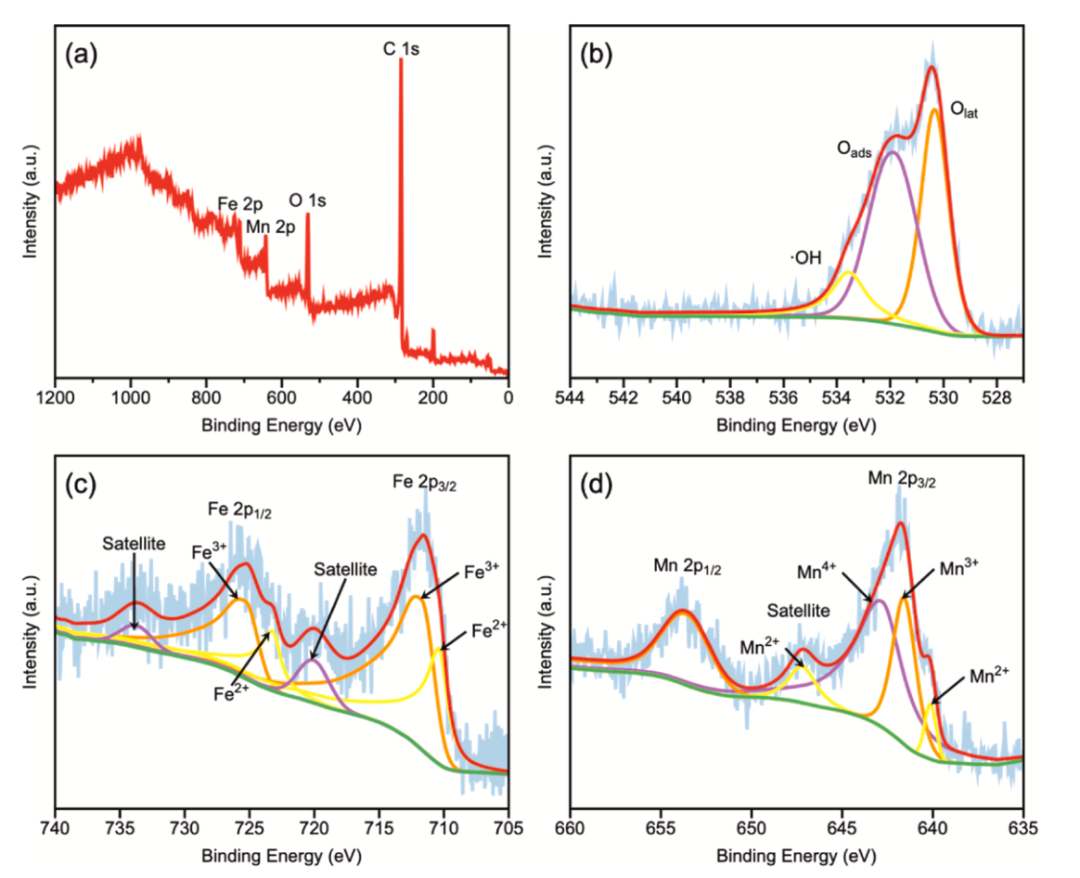
图3 (a) Fe/Mn@CC的XPS全谱和XPS高分辨率扫描谱(b)O 1s, (c)Fe 2p和(d)Mn 2p
Fe/Mn@CC的XPS全扫描光谱在图3(a)中显示,证明了元素C、O、Fe和Mn的存在以及Fe和Mn的成功掺杂到碳结构中。Fe主要以Fe2+和Fe3+的形式存在,Mn主要以Mn2+、Mn3+和Mn4+的形式存在。这些发现表明,大多数金属处于氧化状态。
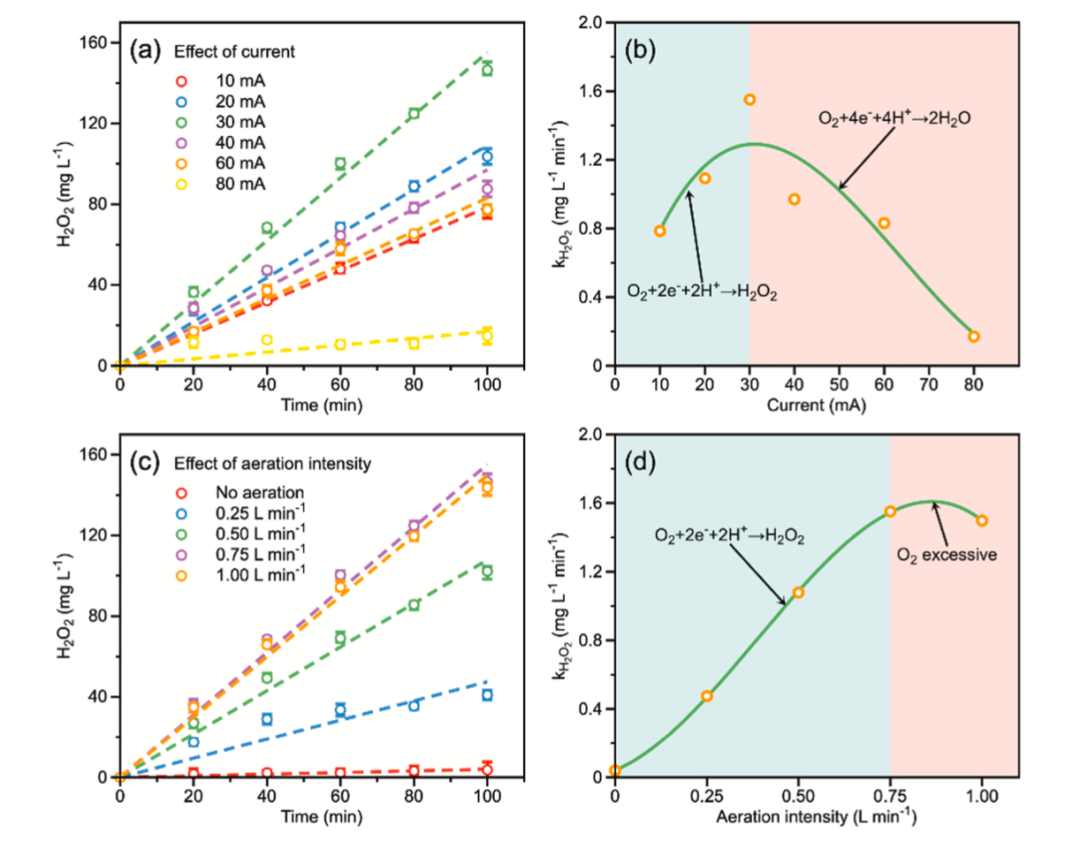
图4 (a)不同电流和(c)不同曝气强度下H2O2的产量;
(b) (d)表示(a)和(c)生成H2O2的速率常数
(pH=3,I=30 mA,通气强度=0.75 L min−1,[Na2SO4]=0.1m)
图4中测量了各种条件下的H2O2产量。图4(b)显示,随着电流从10 mA增加到30 mA,H2O2的产量从0.785增加到1.552 mg·L−1 ·min−1。然而,电流继续增加到80 mA,H2O2的产量从1.552稳步下降到0.17 mg·L−1 ·min−1,这可能是由于在较高电流密度下引起的其他反应。阴极表面上的O2还原反应可通过四电子途径生成H2O或通过双电子途径生成H2O2。在小电流下,O2接触较少的电子并容易产生H2O2,而在大电流下,更多的电子在O2周围转移,并且容易产生H2O。这解释了30mA后H2O2生产速率下降的原因。
图4(d)显示了曝气强度从0增加到0.75 L·min−1时,H2O2的产量从0.040直接增加到1.552 mg·L−1·min−1。这可能是因为较高的曝气强度有利于分子O2和电子之间的接触。当曝气强度进一步增加时,H2O2的产生不会增加,这可能是因为O2对于电极上的活性位点来说过多。总之,电流30 mA和曝气强度0.75 L min−1是产生H2O2的最佳条件。

图5 在不同条件下(a)不同改性阴极、(b)外加电流、(c)初始MIT浓度和(d)曝气强度,非均相EF过程中的MIT降解
(pH=3,[MIT]=50 mg·L−1、[Na2SO4]=0.1m,I=30mA,
通气强度=0.75L·min−1含铁/Mn@CC阴极)
在60min内,Fe/Mn@CC阴极对MIT的去除效率最高(90.6%),速率常数为0.069 min− 1。随着电流从10 mA增加到40 mA,相应的反应速率常数从0.034增加到0.069 min−1,表明降解效率随着电流的增加而增加。一方面,电极表面上的O2分子可以接触更多的电子。另一方面,电流越大,越有利于催化剂的还原和再生。因为高电流会增加电子转移能力,从而使金属元素很容易从高价态转变为低价态。
当电解反应为60min,MIT浓度(30、50、60和70 mg·L−1)相应的MIT去除率分别为80.0%、90.6%、90.5%和66.3%。当MIT浓度从50增加到70 mg·L−1时,反应速率常数从0.064降至0.017 min−1。这种现象主要是由于(1)过量污染物分子占据催化剂或活化剂活性位点和(2)污染物降解生成大量ROS中间体。当初始浓度为30 mg·L−1时,降解速率仅为0.024 min−1,这是因为当MIT浓度低时,分子扩散速率也变低。
曝气强度从0增加到0.75 L·min−1,MIT降解速率从0.002 min−1快速增加到0.081 min−1,这是因为,一方面,大量气体可以增加电极表面和溶液之间接触界面处的传质过程,这有利于提高MIT及其中间产物降解效率。另一方面,可以提高H2O2和⋅OH的产量。
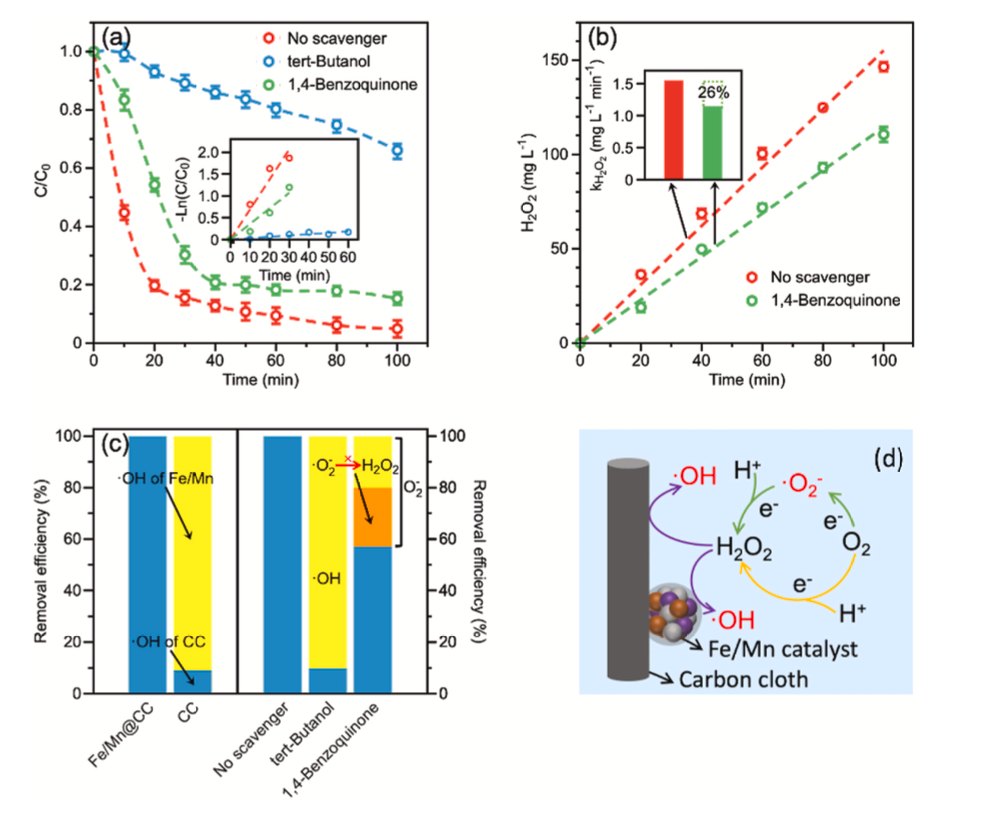
图6 (a)掩蔽不同自由基时MIT的降解
(b)掩蔽条件下H2O2的产量
(c)不同电极的·OH贡献率(左)
不同自由基的降解MIT贡献率(右)
(d)自由基形成机理示意图
(pH=3.0,[MIT]=50 mg·L−1、[Na2SO4]=0.1m,I=30mA,通气强度=0.75L·min−1)
通过掩蔽实验可知,当叔丁醇用作掩蔽剂时,MIT去除率从95.2%降至34.0%,表明⋅OH在EF过程中起着重要作用。添加1,4-苯醌后,MIT去除率降至85.7%,因为⋅O2−掩蔽会阻止H2O2和⋅OH的生成,最终阻止MIT的降解。图6(c)显示在Fe/Mn@CC降解MIT过程中,Fe/Mn催化H2O2生产⋅OH占90.9%,其余直接由CC催化。

图7 非均相EF工艺中不同阴极的反应机理示意图
基于表征、电化学和降解对Fe/Mn@CC电极进行EF机制总结(图7)。Mn具有高峰值电势,这意味着Mn可以快速获得电子,有利于催化反应的加速。通过金属催化剂从还原状态变为氧化状态催化H2O2生成⋅OH。Mn单独作为催化剂不容易产生电子,而Fe容易产生电子。当Fe和Mn结合时,Fe的电子给予能力进一步提高,这可能是因为Mn将电子转移到Fe,Fe将电子转移催化。因此,Fe/Mn@CC电极有利于提高EF降解效率。